Un reciente artículo publicado por el grupo de Matthew Daugherty, profesor de la Universidad de California en San Diego, explica el origen evolutivo de uno de esos “pequeños cambios”. Y paradójicamente podría ser definido como un “gran robo”.
¿Conoce el libro El relojero ciego de Richard Dawkins? Quizás no sea tan famoso como su gran éxito El gen egoísta, pero es una buena lectura si le interesa el tema de la evolución de los seres vivos.
En su primera parte, Dawkins se dedica a explicar la solución a uno de los asuntos que más inquietaba a Charles Darwin: el origen evolutivo de algo tan complejo como el ojo a partir de la acumulación progresiva de pequeños cambios heredables. En sus páginas explica cómo los diferentes animales han resuelto de diversas maneras ese problema, desde el órgano de visión del calamar hasta el de los seres humanos.
Un reciente artículo publicado por el grupo de Matthew Daugherty, profesor de la Universidad de California en San Diego, explica el origen evolutivo de uno de esos “pequeños cambios”. Y paradójicamente podría ser definido como un “gran robo”.
El vaivén del retinal y el retinol
Hace más de 500 millones de años, el ancestro de todos los vertebrados integró en su genoma un gen de una bacteria gracias a un proceso de transferencia genética horizontal. Ese gen evolucionó y dio lugar a la proteína de unión al retinoide interfotorreceptor (IRBP por sus siglas en inglés).
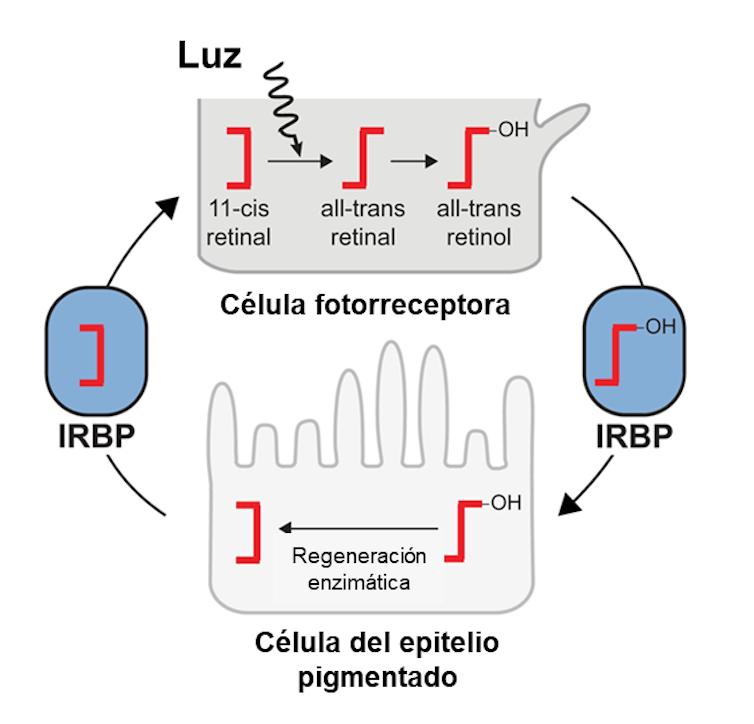
¿Para qué sirve la proteína IRBP? Nuestros ojos pueden sentir la luz gracias a unas células fotorreceptoras que contienen una molécula fotosensible llamada cis-retinal. Cuando un fotón incide sobre ella, experimenta una serie de cambios que la transforman en trans-retinal y luego en retinol. Entonces, la célula fotorreceptora manda una señal al cerebro.
En ese momento, el retinol debe reciclarse. Para ello sale de la célula fotorreceptora y es empaquetado en la IRBP con destino a una célula del epitelio pigmentado de la retina, donde vuelve a convertirse en retinal. Desde allí, es empaquetado otra vez en la IRBP y viaja hasta la célula fotorreceptora con el fin de ser reutilizado.
Resumiendo, la IRBP es un “mensajero” que lleva el retinal o el retinol a sus respectivos destinos. Sin IRBP no habría reciclaje ni, por tanto, visión. De hecho, algunas retinopatías están asociadas con la disminución de los niveles de esa proteína.
En el caso de los invertebrados, el proceso es muy distinto. La molécula fotosensible cis-retinal cambia a trans-retinal gracias a la luz azul. Y se recicla cuando la luz naranja transforma el trans-retinal otra vez en cis-retinal. Es decir, las moléculas fotosensibles no necesitan abandonar la célula fotorreceptora. El camino evolutivo del mecanismo molecular de la visión es completamente distinto entre invertebrados y vertebrados.
En busca del origen bacteriano
El peculiar parecido entre el gen que codifica para la IRBP humana y un gen que se encontraba en bacterias se conocía desde el año 2001, cuando fue secuenciado el genoma humano. Sin embargo, se pensaba que podría ser algún tipo de error en el análisis o una contaminación de la muestra con ADN bacteriano.
Matthew Daugherty no pensaba lo mismo. Lo que hizo su grupo fue buscar genes semejantes en el genoma de otras especies de vertebrados que no estuviera en otros grupos animales. Eso podría indicar un “salto” desde las bacterias a los animales.
Es el caso del gen para la IRBP. Está presente en todos los vertebrados, desde la lamprea marina hasta los simios. Y las proteínas más parecidas a ella son las peptidasas bacterianas, cuya función consiste en reciclar otras proteínas mediante proteolisis. Gracias a este proceso, la peptidasa es capaz de degradar una proteína para reutilizar sus aminoácidos en la síntesis de nuevas proteínas.
Cuando el gen bacteriano se transfirió al ancestro de los vertebrados sufrió una serie de modificaciones, que le hicieron perder su actividad proteolítica a cambio de ganar la función de unirse al retinal y el retinol.
Una de las transformaciones fue una doble duplicación del gen. La peptidasa bacteriana es una proteína de 295 aminoácidos con un solo dominio funcional. ¿Qué significa eso? Las proteínas funcionan como herramientas, así que imaginemos que la peptidasa bacteriana fuera una navaja de una sola hoja. Con la doble duplicación pasó a tener 1 247 aminoácidos y cuatro dominios. Es decir, se transformó en una navaja suiza con cuatro herramientas distintas.
Así que tenemos una pieza más del rompecabezas que explica la formación del ojo, pero también plantea unos cuantos enigmas más. ¿Cuál fue el proceso de esa transferencia horizontal de genes entre una bacteria y el ancestro de los vertebrados? ¿Por qué solo afectó a las células involucradas en la visión?
Como suele suceder en ciencia, cuando respondes una pregunta aparecen otras cien.![]()
Manuel Sánchez Angulo, Miembro de la Sociedad Española de Microbiología. Profesor Titular de Microbiología, Universidad Miguel Hernández
Este artículo fue publicado originalmente en The Conversation. Lea el original.



![El mono ‘Punch’ se hace viral al adoptar un peluche como madre sustituta [VIDEO] El mono ‘Punch’ se hace viral al adoptar un peluche como madre sustituta [VIDEO]](https://f.rpp-noticias.io/2026/02/18/027227-4ef4-4a70-a39d-bed764aa58c8-hd-web-1840023mp4_1840024.jpg?width=160&quality=60)



![Virginia Fonseca, novia de Vinicius Junior, fue coronada reina en el carnaval de Río de Janeiro [FOTOS] Virginia Fonseca, novia de Vinicius Junior, fue coronada reina en el carnaval de Río de Janeiro [FOTOS]](https://f.rpp-noticias.io/2026/02/18/portada_2953137.jpg?width=160&quality=60)
![¡En plena audiencia! Acusado atacó a jueza que le negó la libertad condicional [VIDEO]](https://e.rpp-noticias.io/small/2024/01/04/mmd-vd-20240104-clj-usa-justiciacriminalidad-349g2vy-es-1520871mp4_1520872.webp)








