Una de las razones es la heterogeneidad. El tumor está formado por células propias –las células tumorales en sí–, que además no son exactamente iguales. A esto hay que sumar el llamado microambiente tumoral, conformado por células de soporte, células del sistema inmune, células del sistema vascular, etc.
No hay nada más devastador para un paciente con cáncer y para su familia que un tratamiento eficaz de repente deje de funcionar y el tumor regrese de manera más agresiva. La resistencia a monoterapia (basada en un solo medicamento) lamentablemente ocurre con bastante frecuencia. Investigar y conocer los mecanismos moleculares que la causan es clave para tratar a los pacientes oncológicos.
Gracias al trabajo conjunto de mi laboratorio en el Instituto IMDEA Alimentación y el del Dr. James Fagin en Nueva York (MSKCC) hemos encontrado una nueva causa de resistencia en cáncer de tiroides con mutaciones en el gen BRAF: la deslocalización de una proteína dentro de la célula. No es solo que esa proteína no esté donde deba estar, sino que se la “fuerce” a estar “descolocada”.
Cuando los fármacos no funcionan
La resistencia a los medicamentos se define como la capacidad de las células del cáncer de superar la acción del fármaco y sobrevivir. En esta enfermedad hay dos tipos principales de resistencia: intrínseca y adquirida.
La primera se debe a que un grupo de células dentro del tumor poseen una alteración genética o un estado celular preexistente (que se desconoce) y no va a responder a los medicamentos. Por su parte, la resistencia adquirida ocurre durante el tratamiento, cuando las células cancerosas buscan rutas alternativas que compensen la función de la ruta bloqueada por el fármaco para sobrevivir.
Problemas de “fontanería”
De una manera muy simplista, pensemos en las rutas moleculares como un sistema de tuberías que se interconectan entre sí con un patrón muy intrincado del cual solo conocemos una parte; el resto está oculto y no sabemos sus proporciones.
Hay una fuga, agua por todas partes (tumor). Buscamos la causa y vemos que en una de las tuberías la llave de paso no cierra, está rota (mutación). La solución es sencilla: bloqueamos la tubería (tratamiento). Pero para nuestra sorpresa, al cabo de un rato sigue saliendo agua (resistencia).
Esto puede deberse a diversas causas:
Volvemos a buscar y resulta que se ha roto otra conexión (nueva mutación).
El agua se canaliza por una tubería que normalmente no se usaba (rutas paralelas).
La tubería tiene una sustancia que hace que el pegamento de bloqueo se degrade (adaptación del metabolismo y degradación del fármaco).
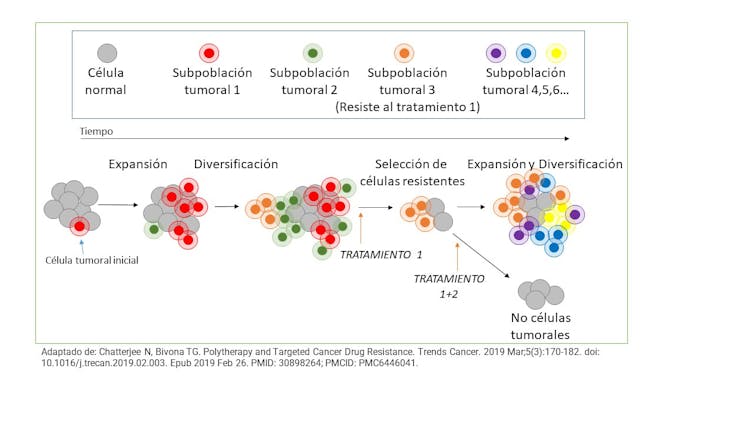
Desafortunadamente, no hay una respuesta única; no ocurre lo mismo en todos los tipos de tumores, ni en todos los pacientes con el mismo tipo de tumor.
Una de las razones es la heterogeneidad. El tumor está formado por células propias –las células tumorales en sí–, que además no son exactamente iguales. A esto hay que sumar el llamado microambiente tumoral, conformado por células de soporte, células del sistema inmune, células del sistema vascular, etc.
Para colmo, también hay diferencias entre diferentes pacientes afectados por el mismo tipo de tumor. Haciendo otro símil, pensemos en un concurso de tartas de fresa, en el que participan un sinfín de tipos y recetas diferentes. Incluso si se han elaborado con la misma receta, no todas saben igual, ¿verdad?
Y por último, el tumor evoluciona con el tiempo. Es decir, aunque inicialmente surja de una alteración en una única célula y esta se reproduzca de manera incontrolada, las células hijas adquieren nuevas características que las hacen diferentes a sus progenitores, como la vida misma.
YAP1 no vuelve a su sitio
La búsqueda de todas esas posibilidades y alternativas es clave para superar la resistencia a la medicación y tratar al paciente oncológico. Es el caso de YAP1, una proteína fundamental para que funcione la célula cuyo “lugar de descanso” es el citoplasma celular y el de “trabajo”, el núcleo.
En condiciones habituales, YAP1 se traslada al núcleo para inducir la expresión de genes relacionados con el funcionamiento normal de la célula y cuando ha completado su cometido, regresa al citoplasma. Si no se produce este cambio de localización, YAP1 se mantiene activado en el núcleo de manera constitutiva, sobrecargando el sistema y expresando genes relacionados con formación de tumores y resistencia a tratamiento.
En cáncer de tiroides con mutación en BRAF comprobamos que el tratamiento con un inhibidor especifico de esta proteína no era efectivo para aquellos tumores que tenían YAP1 fijado en el núcleo (resistencia intrínseca). Y los tumores con YAP1 en el citoplasma (tras un efecto inicial del fármaco) se volvían resistentes debido a que la proteína regresaba al núcleo. Si al inhibidor le añadíamos un tratamiento para bloquear YAP1, este volvía a ser efectivo.
Claramente esto es mucho más complejo. Pero hay una estrategia prometedora para atenuar de una manera más efectiva la resistencia a los medicamentos y aumentar la supervivencia del paciente. Consistiría en administrar una terapia inicial combinada que prevenga o retrase la evolución de los tumores y/o cambiar dinámicamente dicho tratamiento durante la respuesta tumoral antes de que surja completamente la resistencia.![]()
María Elena Rodríguez García-Rendueles, Investigador principal: cáncer de tiroides, IMDEA ALIMENTACIÓN
Este artículo fue publicado originalmente en The Conversation. Lea el original.




![Alí Jamenei, el líder supremo iraní que acaparó el poder en el país desde 1989 [PERFIL] Alí Jamenei, el líder supremo iraní que acaparó el poder en el país desde 1989 [PERFIL]](https://f.rpp-noticias.io/2026/02/28/444344_1843696.jpg?width=160&quality=60)



![¡En plena audiencia! Acusado atacó a jueza que le negó la libertad condicional [VIDEO]](https://e.rpp-noticias.io/small/2024/01/04/mmd-vd-20240104-clj-usa-justiciacriminalidad-349g2vy-es-1520871mp4_1520872.webp)






![Alí Jamenei, el líder supremo iraní que acaparó el poder en el país desde 1989 [PERFIL] Alí Jamenei, el líder supremo iraní que acaparó el poder en el país desde 1989 [PERFIL]](https://f.rpp-noticias.io/2026/02/28/444344_1843696.jpg?width=320&quality=80)

