Imagine que su sistema nervioso es un conjunto de cables interconectados. Como en la vida real, esos cables están recubiertos por una capa aislante. Ahora imagine que, por ciertas circunstancias, la envoltura comenzara a desaparecer.
Imagine que su sistema nervioso es un conjunto de cables interconectados capaces de registrar la información de todo lo que ocurre a su alrededor y proporcionar una respuesta. Como en la vida real, esos cables están recubiertos por una capa aislante. Ahora imagine que, por ciertas circunstancias, la envoltura comenzara a desaparecer. No parece prometer nada bueno, ¿verdad? Y lo que es peor, ¿cómo volvemos a recubrir los cables?
Para buscar respuestas, centremos nuestra atención en la vaina de mielina, el aislante que protege nuestras neuronas.
Envolturas aislantes formadas por membranas celulares
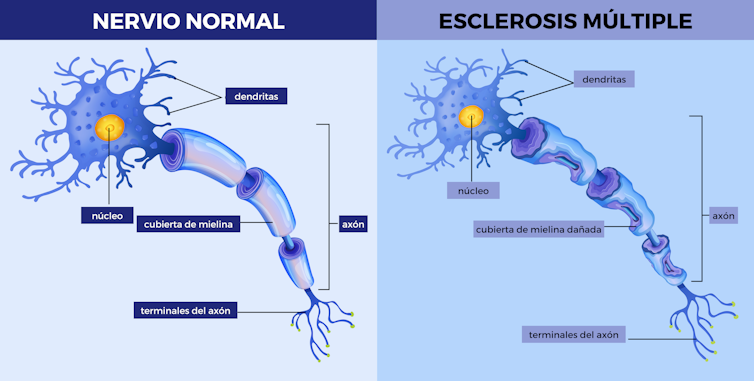
Gracias a las imágenes difundidas por los medios de comunicación, nos representamos las neuronas como células con forma de estrella de la que surgen numerosas prolongaciones. La mayoría son cortas (las dendritas), mientras que una de ellas (el axón) se extiende más que las otras. Esta última será la que formará, junto con otros axones, los nervios de nuestro cuerpo.
Además, al visualizar esta hipotética neurona, la vemos desnuda, pero no es así. Su axón está recubierto, a tramos interrumpidos, por una envoltura denominada vaina de mielina.
En realidad, dichos recubrimientos están constituidos por membranas de otras células, pertenecientes principalmente a dos tipos: en el sistema nervioso periférico, las células de Schwann envuelven los axones que inervan las extremidades, tórax y abdomen; mientras que en el sistema nervioso central, formado por el encéfalo y médula espinal, los oligodendrocitos construyen esas vainas.
Para formar las fundas protectoras, tanto células de Schwann como oligodendrocitos se enrollan en varias vueltas concéntricas alrededor del axón. Ambas forman parte del grupo de células gliales, cuya misión no es transmitir los impulsos nerviosos, sino dar soporte metabólico a las neuronas vecinas.
Impulsos nerviosos “saltarines”
La utilidad del recubrimiento de mielina radica en la forma de propagación que tiene el impulso nervioso. Cuando una neurona recibe un estímulo, este provoca una inversión transitoria de la polaridad de su membrana. O dicho en otras palabras, el interior celular se vuelve positivo con respecto al exterior negativo, como si de una pila eléctrica se tratase.
Esa inversión recorre toda la membrana neuronal con un efecto dominó hasta que llega a la siguiente neurona o al músculo sobre el que se genera la respuesta ante el estímulo. Pero, aunque no seamos conscientes, el impulso nervioso tiene que recorrer distancias maratonianas –hasta un metro– para lograr su objetivo. ¿Y cómo se puede acelerar ese viaje? Aislando gran parte de la membrana del axón y dejando libres solo unos pocos lugares. Así, el impulso se ve obligado a “saltar” sobre zonas donde no hay vaina de mielina.
Esta conducción saltatoria del impulso nervioso se consigue gracias a la composición de la membrana de las células que forman la vaina. Su elevado porcentaje de lípidos (70-85 %), como la esfingomielina o el galactocerebrósido, es lo que otorga su carácter aislante.
La esclerosis múltiple y otras enfermedades desmielinizantes
Existen numerosas enfermedades del sistema nervioso central en las que, por circunstancias de origen desconocido, se produce una alteración en la vaina de mielina que rodea las neuronas. Es el caso, por ejemplo, de la esclerosis múltiple, desencadenada por una pérdida progresiva de oligodendrocitos que forman el recubrimiento. En dolencias de este tipo, y si la disminución de mielina es muy acusada, se produce la pérdida de señalización nerviosa en las áreas afectadas.
Actualmente, las enfermedades desmielinizantes no tienen cura, por lo que la comunidad científica está realizando un gran esfuerzo para tratar de entender las causas de estas patologías.
Dado que uno de los factores clave es la pérdida de oligodendrocitos, entender el nacimiento y desarrollo de estas células es esencial. Se ha descrito que proceden de un linaje derivado de las células madre neurales que da lugar a los progenitores de los oligodendrocitos. Durante las fases de diferenciación, dichos progenitores comienzan a expresar genes que les llevan a fabricar las proteínas y lípidos propios de la vaina de mielina.
Una de las vías de señalización en este proceso es la denominada vía Wnt, vital para el proceso de mielinización tanto en etapas de desarrollo como tras una lesión y que, según se ha visto, está hiperactiva en pacientes con esclerosis múltiple. No obstante, esta vía ejerce su acción a través de un grupo diverso de proteínas y se desconoce exactamente su función en las distintas etapas del desarrollo de los oligodendrocitos.
CK2, una diana para recuperar la mielina perdida
Pero se ha abierto una ventana de esperanza: a mediados de 2023, el grupo de la Dra. Hyun Kyoung Lee, de la Universidad de Texas, describió un nuevo eje de regulación dentro de la vía Wnt, formado por las proteínas Daam2 y CK2.
Daam2 mantiene a los progenitores en un estado quiescente, sin diferenciar. Pero cuando esta proteína es fosforilada por CK2 –es decir, recibe la transferencia de un grupo de fosfato–, queda inactivada. Es entonces cuando se desbloquea el desarrollo de los progenitores, que pueden convertirse en oligodendrocitos maduros. Los autores del artículo han observado este proceso tanto en el desarrollo normal de los animales como en la recuperación después de un traumatismo.
En sus experimentos, los investigadores utilizaron un modelo de ratón que presentaba mayores niveles de CK2. Como consecuencia, se observó una mayor fosforilación de Daam2, que inducía la diferenciación de los progenitores y, en menor medida, la mielinización por parte de los oligodendrocitos maduros.
De esta forma, CK2 surge como la primera diana farmacológica que podría utilizarse para tratar las enfermedades desmielinizantes. Mediante la protección de la funda, los daños no trascenderían al interior del nervio y se podría conservar intacto el impulso neuronal subyacente. Es decir, los cables volverían a estar plenamente operativos.![]()
Ángela Jimeno Martín, Profesora de Bioinformática y Biomedicina, Universidad San Jorge
Este artículo fue publicado originalmente en The Conversation. Lea el original.












![¡En plena audiencia! Acusado atacó a jueza que le negó la libertad condicional [VIDEO]](https://e.rpp-noticias.io/small/2024/01/04/mmd-vd-20240104-clj-usa-justiciacriminalidad-349g2vy-es-1520871mp4_1520872.webp)








